

Acest web site a fost optimizat pentru Browser-ul Microsoft Internet Explorer 6.0.
|
 |
||||||
|
4.3.1 Topirea și solidificarea în condiții de echilibru Punctele fixe de definiție ale SIT-90 sunt puncte triple și puncte de solidificare/topire (Tabelul 4.1). Trebuie să menționăm aici că procesele de topire și solidificare nu sunt specifice numai punctelor de solidificare/topire, ci stau și la baza realizării punctelor triple: atingerea stării de echilibru între cele trei faze ale unei substanțe este posibilă fie prin topirea fazei solide, fie prin solidificarea fazei lichide a substanței de punct fix, în prezența vaporilor săi (Figura 4.1). Pentru o presiune dată, topirea și solidificarea unui metal ideal de pur un singur izotop cu o orientare definită într-o rețea ideală - are loc la o temperatură unică (Figura 4.1) și implică absorbția sau eliberarea căldurii latente de topire. Căldura latentă de topire este energia termică ce trebuie să fie absorbită de 1 kg de substanță pentru a rupe forțele de legătură interatomice sau intermoleculare, modificând starea atomilor dintr-o stare cristalină ordonată într-o stare lichidă dezordonată, însă omogenă. Procesul este reversibil, astfel încât, la solidificare, căldura latentă este degajată pentru ca atomii și moleculele să capete o structură mai ordonată. Această eliberare de căldură determină creșterea temperaturii din starea de supra-răcire a lichidului până la palierul de solidificare. Dacă se folosește o cantitate suficientă de metal (150 cm3 este un volum tipic al unui lingou pentru un punct fix), căldura latentă este suficientă pentru a menține metalul și termometrul imersat în el la o temperatură constantă timp de câteva ore, în vreme ce se produce solidificarea. Căldura latentă de topire a substanțelor folosite pentru materializarea punctelor fixe variază între 11,8 kJ/kg pentru mercur și 334 kJ/kg pentru apă. Prezența unei mici cantități de impurități sub formă de metale dizolvate va schimba, însă, temperatura la care volumul de metal se topește sau se solidifică și va face ca topirea și solidificarea să se producă nu la o valoare unică a temperaturii, ci într-un interval de temperatură. Un astfel de metal poate fi tratat ca un aliaj foarte diluat (soluție diluată). Diagrama de fază este o reprezentare grafică folosită pentru a arăta condițiile de echilibru între diferitele faze. Am discutat mai înainte despre cea mai simplă diagramă de fază - diagrama presiune-temperatură a unei substanțe chimic pure (Figura 4.1). În acest caz, diagrama arată - în spațiul presiune-temperatură - liniile de echilibru între faze.
Se pot construi și tipuri mai complexe de diagrame de fază. Un exemplu este diagrama care reprezintă temperatura în funcție de concentrațiile unor substanțe dintr-un amestec: diagrama are o axă pentru temperatură și n-1 axe pentru concentrațiile componenților. O astfel de diagramă ne permite să examinăm efectele fundamentale care se produc într-un sistem atunci când temperatura și compoziția sa se schimbă. Prin urmare, examinarea diagramei de fază este o modalitate prin care pot fi estimate efectele impurităților asupra temperaturii de echilibru a unui metal pur. Din păcate, acest tip de analiză are o aplicabilitate destul de redusă în termometrie: dezvoltarea diagramelor de fază se bazează pe determinări experimentale și majoritatea cercetărilor metalurgice sunt direcționate spre sisteme mai puțin diluate decât în cazul punctelor fixe de temperatură; în plus, diagramele de fază publicate ilustrează, în general, sisteme de numai două componente or, chiar în metalele cu cea mai înaltă puritate disponibilă, există trei sau mai multe tipuri de impurități.
Figura 4.2 [7] reprezintă diagrama de fază tot pentru o substanță chimic pură ca și Figura 4.1, numai că, în acest caz, stările fizice ale sistemului sunt reprezentate în funcție de temperatură și compoziție. Este vorba de un sistem metalic (staniu) ideal de pur, având, deci, un singur component (C = 1). Într-un astfel de sistem, morfologia frontului de cristalizare și forma cristalelor rezultate sunt determinate în totalitate de condițiile regimului termic în care se produce cristalizarea. Dacă temperatura unui volum de staniu aflat în fază solidă crește, se va atinge un punct de tranziție de fază și anume, punctul de topire al staniului (231,928 ºC, conform SIT-90), la care începe să se formeze staniu lichid. În cursul topirii se absoarbe căldură. Tranziția continuă până când tot staniul devine lichid. Pe durata tranziției, temperatura este invariantă deoarece căldura furnizată din exterior este absorbită exclusiv pentru avansarea topirii și nu determină creșterea temperaturii metalului. Când staniul este topit în întregime, furnizarea suplimentară de căldură va determina din nou creșterea temperaturii, până când metalul lichid începe să fiarbă, producându-se tranziția din faza lichidă în faza gazoasă. Diagrama din Figura 4.2 este o idealizare, întrucât în lumea reală nu există metale cu puritatea de 100 %. Prin urmare, orice metal cu cea mai bună puritate disponibilă trebuie să fie tratat ca un aliaj (soluție diluată), adică un amestec format dintr-o componentă majoritară, metalul A și alte componente metalice sau nemetalice B, C etc. dizolvate in metalul de bază în concentrații foarte mici. Numai că tranziția de fază a unui aliaj nu se mai produce la o valoare unică a temperaturii, ca în cazul metalelor pure, ci într-un interval de temperatură.
Figura 4.3 arată diagrama de fază [8,9,10] - denumită și diagrama binară - pentru un sistem binar A-B (C = 2). Cei doi componenți sunt complet miscibili în ambele faze, solidă și lichidă (de exemplu, sistemul Ag-Au sau Bi-Sb [10]). Compoziția variază de la 100 % element A, la stânga diagramei, până la 100 % element B, la dreapta diagramei, trecând prin toate compozițiile posibile. TA este punctul de solidificare al metalului pur A iar TB este punctul de solidificare al metalului pur B. Diagrama de fază reprezintă grafic compozițiile celor două faze - solidă și lichidă - în funcție de temperatură. Curba solidus reprezintă temperaturile la care o soluție solidă, de orice compoziție dată, începe să se topească. Sub această curbă, sistemul este stabil în fază solidă, adică aliajele sistemului care au temperaturile și compozițiile corespunzătoare punctelor situate în această arie sunt monofazice. Curba liquidus reprezintă temperaturile la care o soluție lichidă, de orice compoziție dată, începe să se solidifice (presupunând că nu are loc supra-răcirea). Deasupra acestei curbe, sistemul este stabil în fază lichidă, adică aliajele sistemului care au temperaturile și compozițiile corespunzătoare punctelor situate în această arie sunt monofazice. În aria cuprinsă între curba solidus și curba liquidus, orice aliaj al sistemului se află sub forma unui amestec de faze și anume, soluție lichidă și cristale de soluție solidă iar compoziția fiecărei faze este dată de intersecția liniei de temperatură cu curba solidus și, respectiv, liquidus. În cazul unei soluții foarte diluate formate dintr-un element majoritar (solventul) în care este dizolvată o cantitate foarte mică dintr-un alt element (solvitul), panta curbei solidus depinde de natura celor două elemente și, în particular, de solubilitatea relativă a solvitului în faza solidă a solventului. Un solvit care este mai solubil în faza lichidă decât în cea solidă coboară punctul de solidificare, în timp ce unul care este mai solubil în faza solidă ridică punctul de solidificare. Așadar, temperaturile de solidificare ale aliajelor sunt fie mai coborâte, fie mai ridicate față de cele ale elementelor pure, în funcție de tipul impurităților dizolvate. Vom analiza, mai întâi, cazul solvitului care coboară temperatura de solidificare a metalului în care este dizolvat. În diagrama binară din Figura 4.3, cazul este reprezentat în partea stângă a desenului, în care: ● elementul majoritar este A, ● solvitul B este mai solubil în faza lichidă decât în cea solidă. O reprezentare mărită a zonei, care evidențiază efectul unei mici cantități de element B în elementul A aproape pur, este arătată în Figura 4.4 (a).
Diagrama prezintă cazul ideal al unei solidificări de echilibru: o solidificare ce se produce suficient de lent încât solidul și lichidul să rămână omogene în B, deși concentrațiile lui B se modifică. Se observă că atunci când aliajul complet topit, ce are compoziția L0, este răcit în condiții de echilibru, compoziția sa rămâne neschimbată până când temperatura ajunge la punctul liquidus, Ti. Imediat începe procesul de germinare prin care debutează cristalizarea: în diverse puncte ale soluției lichide apar simultan primii germeni de cristalizare. Vom presupune pentru moment că nu are loc supra-răcirea lichidului, deși formarea germenilor cristalini necesită existența unei supra-răciri a topiturii sub temperatura liquidus. Pentru ca un germene să fie stabil și să poată crește formând un cristal, el trebuie să aibă o dimensiune minimă, numită rază critică [8]. Embrionii care nu ating raza critică, nu sunt germeni viabili și se redizolvă în faza lichidă. Ceilalți formează primii germeni cristalini de compoziție Si (pe curba solidus), care se separă de soluția lichidă de compoziție Li (pe curba liquidus). Viteza de germinare sau de nucleere este dată de numărul germenilor viabili care apar în unitatea de timp în unitatea de volum. Un germene stabil o dată format continuă să crească și, consumând fază lichidă, se dezvoltă într-un cristal. Creșterea se face prin atașarea atomilor din faza lichidă pe suprafața cristalului, sub formă de straturi monoatomice de dimensiune critică, formându-se germeni bidimensionali. Germenii bidimensionali cresc la rândul lor, prin alipirea unui șir de atomi din faza lichidă. Solidul format inițial, Si, are o concentrație în B mai mică decât lichidul L0 din care provine. Solidificarea continuă și concentrația în B a celor două faze crește: de la Si la Sf de-a lungul curbei solidus, pentru soluția solidă ce se formează și de la Li la Lf de-a lungul curbei liquidus, pentru restul aliajului rămas în fază lichidă. La temperatura Tf, punctul solidus, aliajul este complet solidificat și chiar dacă temperatura scade în continuare, compoziția sa Sf nu se mai modifică. Compoziția Sf a soluției solide rezultate este identică cu compoziția soluției lichide L0 din care provine. Viteza de creștere a cristalelor este mică la începutul și la sfârșitul transformării de fază. Viteza globală este maximă atunci când fracțiunea solidificată reprezintă 50 % din volumul aliajului [8]. 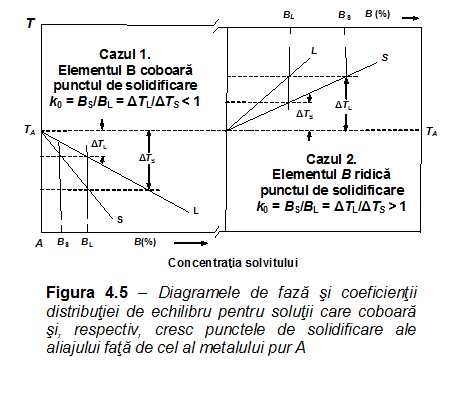
Procesul de solidificare reprezentat în Figurile 4.3 și 4.4 (a) se obține numai în condiții de echilibru termic, la viteze de răcire infinitezimale, care permit o modificare continuă a compoziției fazelor. Astfel, Ti Tf reprezintă intervalul ideal de solidificare al aliajului. Trebuie observat că atât Ti cât și Tf sunt mai coborâte decât temperatura de solidificare TA a metalului pur A, deoarece solvitul B este mai solubil în faza lichidă decât în cea solidă. Variația în timp a temperaturii aliajului la solidificarea în condiții de echilibru este denumită curba termică de solidificare și, pentru cazul analizat, este prezentată în Figura 4.4 (b) (linia continuă). Intervalul ideal de topire al aliajului, care se obține la tranziția din faza solidă în faza lichidă în condiții de echilibru, este cuprins între temperaturile Tf și Ti. Procesul se desfășoară în sens invers celui de solidificare și este pus în evidență de curba termică de topire din Figura 4.4 (c). Soluția solidă este încălzită până la punctul solidus Tf , care semnalează începutul topirii. Tranziția de fază se încheie la punctul liquidus Ti, când aliajul este complet topit; frângerea curbei indică dispariția solidului și începutul curbei de încălzire a aliajului complet lichid. În mod similar poate fi analizat cazul solvitului care ridică temperatura de solidificare a metalului pur în care este dizolvat, caz ce este reprezentat în colțul din dreapta jos a diagramei binare (Figura 4.3). De data aceasta, B este componentul majoritar și solvitul A este mai solubil în faza solidă decât în cea lichidă. Distribuția solvitului între aliajul solid și aliajul lichid în condiții de echilibru este definită prin coeficientul de distribuție de echilibru, k0 [8, 9, 10]. Coeficientul de distribuție se calculează ca raportul dintre concentrația solvitului în faza solidă (BS) și, respectiv, lichidă (BL), în condiții de echilibru. La punctul liquidus, k0 este definit prin relația:
Figura 4.5 ilustrează cele două cazuri:
|
|||||||
| © 2007 Sonia Gaiță | |||||||